|
 |
 |
سم النحل/الغدد السمية لدى نحل العسل
by Clarence Collison
تـرجمة الدكتـور طـارق مـردود
style="font-
size:16pt;font-family:Tahoma;sans-serif;color:#000000;">
يبدأ نحل العسل العامل في أول استخدام للسم عندما يبلغ سنه حوالي 14 يومًا للدفاع ضد الحيوانات المفترسة والمتسللين.
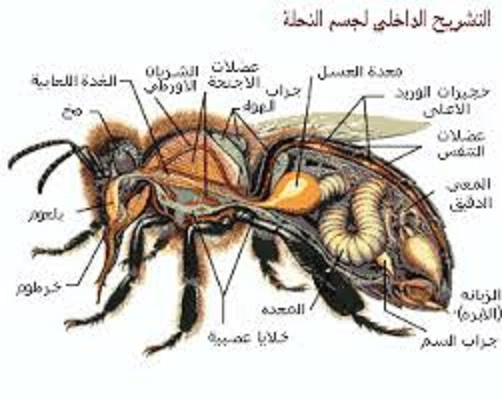
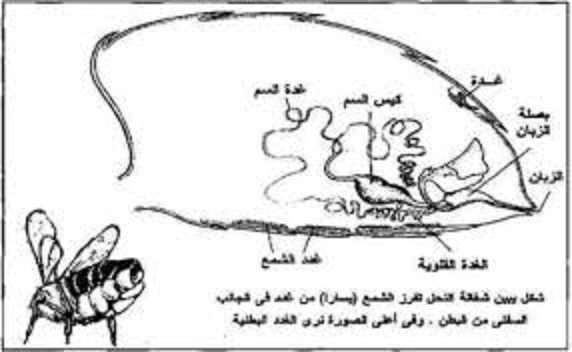
تستخدم شغالات نحل العسل السم للدفاع عن الخلية وعن أنفسهم عندما يتعرضون للأخطار والمفترسات. السم الذي يتم حقنه في الضحية عندما تلدغ الشغالة هو مزيج من البروتينات السامة والببتيدات ، المكون الرئيسي هو بروتين يسمى ميليتين melittin (Winston 1987). يحتوي السم على مركبات أخرى مثل هيالورونيداز ، فوسفوليباز أ ، فوسفاتاز حمض وهستامين. تفرز الغدة السمية والخزان مزيجًا من 50 مكونًا محددًا على الأقل. لعدد من هذه المكونات تأثيرات سامة كبيرة على العديد من أنواع الحشرات والفقاريات (Bridges and Owen 1984). قد تكون الطبيعة المعقدة للسم بسبب التنوع الواسع للآفات الحشرية والفقارية والحيوانات المفترسة التي قد تهاجم خليةالنحل ؛ يبدو أن المكونات المختلفة للسم مهمة في صد أنواع مختلفة من المهاجمين (Winston 1987). هناك غدتان مرتبطتان بقاعدة جهاز اللدغ ، السم أو الغدة الحمضية وغدة دوفور (القلوية). تتكون غدة السم من زوج من الأنابيب الطويلة النحيلة الملتفة (المطوية بشكل معقد ، الملتوية ، الملفوفة) التي تطفو بحرية داخل البطن (الدملمف hemolymph) من الجزء الخلفي من البطن (Stell 2012). تحدث الخلايا الإفرازية على طول الأنابيب ، وتفتح قنواتها الصغيرة في قناة مشتركة مبطنة بالكيتين. ينتهي كل نبيب بتضخم غدي صغير ، ويتحد النبيبان في قناة مشتركة قصيرة. تفتح القناة في الطرف الأمامي لكيس السم أو الخزان ، وهذا بدوره يفتح في تجويف المؤخرة عند قاعدة اللدغة (الشكل 1). ترتبط العصابات العضلية بالغدة السامة ويقال أنها تحرك الإفراز إلى داخل كيس السم ، حيث يتراكم السم. تحتوي الجدران الظهارية لكيس السم على بطانة سميكة ومغلفة (بطانة داخلية لعضو) ملقاة في العديد من الطيات العالية. في عنق الكيس تشكل الطيات حلقات عرضية منتظمة ، مما يجعل العنق مفتوحًا بقوة. جدران الكيس السامة ليس لها عضلات ، وبالتالي لا يتم طرد السم من خلال تقلص الكيس. يتم دفعها عبر قناة اللدغة من خلال عمل إبر اللسع وصماماتها (Snodgrass 1956 ؛ Goodman 2003). على طول معظم غدد السم ، توجد وحدات إفرازية مماثلة لها أربعة مكونات رئيسية (خلايا إفرازية وخلايا مجرى الهواء والقنوات وأجهزة النهاية) ، باستثناء الجزء من الغدة القريبة لخزان السم ، حيث تشبه الوحدات الإفرازية تلك الموجودة حول خزان السم. في الوحدات الإفرازية الأخيرة ، يحدث هيكل قمعي بين القناة (التي هي أقصر من الوحدات الإفرازية للغدة) والجهاز النهائي. قد يكون هذا القمع مهمًا في حماية الخلايا الإفرازية حول الخزان من النشاط الخلوي (تدمير الخلية) بواسطة الخليط الكيميائي المعقد الذي يشكل السم (Bridges and Owen 1984؛ Peiren et al.2008). "غدة دوفور Dufour ، التي كانت تسمى سابقًا الغدة الأساسية أو القلوية ، مرتبطة بالسم والغمد اللدغي وغدد Koschevnikov في جهاز اللدغة. " ترتبط غدة دوفور، التي كانت تسمى سابقًا بالغدة الأساسية أو القلوية ، بالسم والغمد اللدغي وغدد Koschevnikov في جهاز اللدغة. على الرغم من العديد من الدراسات ، لا يزال الدور الدقيق لغدة دوفور غير واضح (Martin et al. 2005). غدة دوفور عبارة عن أنبوب أبيض سميك قصير ، ملتف قليلاً ، معتم بشكل غير شفاف. يتكون الجدار الغدي من ظهارة سميكة من خلايا متميزة مبطنة بطبقة رقيقة من الجلد (Snodgrass 1956). تخرج غدة دوفور بين إبر اللدغة. المخرج ضيق للغاية وغير واضح وهو في نفس الوضع في كل من الملكات والشغالات. مخرج الغدة قريب من غشاء سيتوزا ، وهي منطقة من الجلد ، والتي تعمل كمنصة لإطلاق فرمون. وهذا يتفق مع فكرة أن غدة دوفور تفرز مركبات يتم استخدامها في الدفاع من قبل الشغالات أو التكاثر في الملكة والشغالة (Martin et al. 2005). لدى الغدة السامة للشغالة دورة إفرازية واحدة ، تبدأ في نهاية الجذع وتصل إلى أقصى حد لها في اليوم السادس عشر تقريبًا من عمر الشغالة البالغة (روات وآخرون 2006 أ). يتم تخزين السم الذي يتم إنتاجه خلال هذه المرحلة النشطة المكثفة في الخزان (كيس السم) وتدخل الغدة بعدها في عملية الانحلال (أوين وجسور 1976) ، والتي تكتمل بعد حوالي 30 يوم من ظهورها. وهكذا ، لدى شغالات البحث عن الطعام تتميز الخلايا الغدية بعلامات واضحة على الانحطاط ، وتفتقر إلى معظم الهياكل الخلوية المميزة مع النوى والميكروفيلي المحيطة بالقناة (القناة الصغيرة أو القناة) باعتبارها الهياكل الوحيدة التي يمكن تمييزها. تم العثور على حويصلات ذات أحجام وأشكال غير منتظمة في السيتوبلازم المتبقي. إجمالاً ، يتم إنتاج حوالي 0.3 مجم من السم.
توجد غدة السم في طبقات الشغالة والملكة ، لكن الملكات بها غدد أكبر بكثير من الغدد لدى الشغالة. العمال وإنتاج المزيد من السم. تستخدم الملكات السم أثناء المعارك مع الملكات المتنافسة الأخرى ، وهو حدث يحدث بمجرد ظهور imago (مرحلة الكبار الناضجة) ، بينما نادراً ما تستخدم الملكات المخصبة السم. سم الملكة هو نصف قاتل للفئران مثل سم العامل ، وبحلول الوقت الذي تتراوح فيه الملكات من سنة إلى سنتين يصبح سمها غير نشط بشكل أساسي (Schmidt 1995). يبدأ نحل العسل العامل في أول استخدام للسم عندما يبلغ سن 14 يومًا للدفاع ضد الحيوانات المفترسة والمتسللين (Seeley 1985). لا تستخدم الملكات لدغاتها أبدًا للدفاع عن المستعمرة. بدلاً من ذلك ، يتم حجز لسعة الملكة لمكافحة الملكات المتنافسة قبل ظهورها أو التي تظهر خلال نفس الفترة الزمنية. سم الملكة أكثر فتكًا تجاه نحل العسل الآخر من سم العامل (كاتو 1994). تحدث معارك الملكة خلال الأسابيع الأولى من حياة الكبار ، وبعد ذلك قامت الملكة الناجحة بدس الملكات المتنافسة أو تدميرها. بمجرد أن تنضج الملكة وتضع بيضها ، لا تحتاج فقط إلى محاربة الملكات الأخريات ، ولكن أيضًا بطنها المنتفخة تجعلها غير قادرة على القتال بكفاءة. وبالتالي ، تتوافق سموم السم مع علم الأحياء بأن الملكة تحتاج إلى إمدادات وفيرة من السم النشط عند ظهوره وبعد ذلك بوقت قصير ، ولكن ليس في الحياة اللاحقة (Schmidt 1995). ينخفض المحتوى البروتيني لغدد السم من نحل العسل والملكة بعد الأسبوع الأول من حياة البالغين. تفقد غدد سم النحل 90٪ والعاملين 50٪ من البروتين. يسبق فقدان البروتين هذا التغيرات الفوقية في مورفولوجيا الخلايا الإفرازية للغدة السامة (Owen and Bridges 1976). ملكات زرع قديمة كانت تترأس مستعمرة لمدة عام أو أكثر تمتلك سم مختلف بشكل كبير عن ملكات الشباب. كان السم من الملكات القديمة أقل فتكا 15 مرة على الأقل من سموم الملكات الشابات (شميدت 1995). بالإضافة إلى ذلك ، لوحظت تغييرات جذرية في سم الملكات القديمة أثناء تشريح وجمع السم. احتوت الملكات الصغيرات على الدوام خزانات مليئة بالسم الشفاف عديم اللون. تمتلك الملكات المسنات عادة سم السمرة إلى اللون البني الداكن الذي كان لزجًا. في العديد من الملكات القديمة ، أصبح السم لونًا بنيًا داكنًا إلى أسود مادة صلبة تقريبًا لا يمكن جمعها ولم تذوب بسهولة في الماء. "لا تستخدم الملكات لسعاتها للدفاع عن المستعمرة. بدلاً من ذلك ، يتم حجز لسعة الملكة لمحاربة الملكات المتنافسة قبل ظهورها أو التي تظهر خلال نفس الفترة الزمنية " لا يحتوي كيس السم للعامل على سم في وقت ظهوره ، في حين أن الملكات التي ظهرت حديثًا أنتجت بالفعل سمًا (روات وآخرون 2006 ب). تظهر الملكات الحد الأقصى من التوليف من صفر إلى سبعة أيام ، تحدث عملية التنكس مباشرة بعد التزاوج وتتوقف بشكل أساسي عن إنتاج السم في حوالي اليوم 30 (أوين وجسور 1976). يحتوي سم الملكة على الهيستامين أكثر بكثير من السم العامل ، لكنه يفتقر إلى الببتيد MCD (الببتيد المتحلل من الخلايا البدينة) ؛ وبحلول سنة واحدة ، تحتوي سموم الملكة على القليل من فسفوليباز A2 ونصف ذوبان العمال ، ولديها العديد من البروتينات الأخرى. Melittin هو مكون بروتيني رئيسي لسم النحل ، يشتمل على 50 ٪ من وزنه الجاف (هابرمان 1972). تمت دراسة التركيب الحيوي للميلتين في الجسم الحي عن طريق تغذية أحماض أميو المشعة لنحل العسل. تم تحليل مقتطفات من الغدد السم لوجود melittin المسمى ومكونات أخرى. تم دمج النشاط الإشعاعي لأول مرة في الببتيد الآخر الذي يعتبر سلفًا للمليتين (Kreil and Bachmayer 1971). بعد إطعام الليوسين المسمى لعامل النحل العامل والملكة من مختلف الأعمار ، تم تحليل توليف مادة الميلتين وسلائف بروميليتين في غدة السم. تحدث تغيرات ملحوظة في تخليق بروميليتين ومعدل تحويله إلى مليتين أثناء نضج الحشرات. في ملكة النحل ، تعمل كلتا العمليتين بالفعل بالقرب من السعة الكاملة في الحشرات الناشئة حديثًا. من ناحية أخرى ، في النحل العامل يزداد إنتاج بروميلتين ببطء ليصل إلى الحد الأقصى في اليوم الثامن إلى العاشر ثم ينخفض. خلال اليومين الأولين لوحظ فقط توليف بروميلتين ، في حين تم الكشف عن التحويل إلى ميليتين فقط في وقت لاحق (Bachmayer et al. 1972). تزداد كمية مادة الميلتين من وقت حدوث التآكل إلى عمر يبلغ حوالي أربعة أسابيع عند وجود حوالي 500 ميكروغرام من مادة الميلتين. في النحل الأكبر سنًا (خمسة إلى ستة أسابيع) ينخفض مستوى الميلتين إلى حوالي 250 ميكروغرام. يكون توليف Melittin أكثر نشاطًا في النحل الذي يتراوح عمره بين أسبوع إلى أسبوعين بعد الانهيار. يتغير محتوى مادة الميلتين في نظام السم مع تقدم الصيف. مستويات Melittin في النحلة في أي عمر أكبر من أسبوع واحد أقل في منتصف أغسطس مما كانت عليه في النحلة من نفس العمر في أوائل يونيو (Owen and Pfaff 1995). Phospholipase A2 هو الأكثر فتكًا من ببتيدات وسم نحل العسل والمليتين وهو أقل فتكًا بقليل ، وهو الأكثر وفرة. أظهرت التحاليل المتزامنة للمليتين ، فوسفوليباز ومزيج من الاثنين في خليط 3: 1 الطبيعي في سم النحل أن النشاط المميت للخليط واحول نفس السم الأصلي. كانت هذه القيمة أقل من تلك الخاصة بالمليتين أو الفسفوليباز وحدها وتشير إلى أن التآزر بين الببتيدات لا يحدث. تتوافق النتائج مع الأنشطة المميتة المستقلة لمكونات السم ، وتظهر أن الميلتين ليس فقط المهيمن ، ولكن أيضًا العنصر المميت الرئيسي لسم نحل العسل (Schmidt 1995). أوين وآخرون. (1990) قياس نشاط فوسفوليباز A2 في سم النحل العامل في الأعمار المعروفة. توجد مستويات منخفضة من فوسفوليباز A2 في نظام السم في وقت حدوث الانهيار (ظهور من حالة الخلدان). يزداد نشاط Phospholipase A2 في السم بشكل مطرد خلال 10 أيام بعد الانهيار. يتم الحفاظ على أقصى مستويات الفوسفوليباز A2 (حوالي 40 ميكروغرام من الفوسفوليباز A2 / كيس السم) خلال بقية حياة النحلة العاملة في الصيف. الهستامين مميت لنحل العسل بمقدار 50 مرة مقارنة بالثدييات (أوين وآخرون 1977). تم قياس كميات الهستامين والهيستيدين في غدد سم نحل العسل وأنسجة خزان السم والسم المأخوذة من النحل العامل الواحد (أوين وبريدوود 1974). لم يكن أي من مكونات السم هذه موجودًا في النحل الناشئ حديثًا ، تم اكتشاف الهيستامين والهيستيدين لأول مرة في سم النحل البالغ من العمر أسبوعًا ، وزادت الكميات الموجودة لمدة ثلاثة إلى أربعة أسابيع ، ووصلت إلى الحد الأقصى ، ثم سقطت مرة أخرى في ستة أسابيع النحل القديم. قام أوين وجسور (1982) بتحليل سم نحل العسل من العصور المعروفة للدوبامين (DA) والنورادرينالين (NA). ووجد الباحثون كلا من الاختلاف المعتمد على العمر والتغيرات الموسمية في مستويات DA و NA في السم. روات وآخرون. (2006 أ) تحليل تأثير علاجات هرمون الأحداث على البنية التحتية للغدد السامة للعامل. تلقى العمال الذين ظهروا حديثًا تطبيقًا موضعيًا لميكرول واحد من هرمون الأحداث المخفف في الهكسان ، بتركيز 2 ميكروغرام / ميكرولتر. تم استخدام نوعين من الضوابط. تلقت مجموعة مراقبة واحدة أي علاج وتلقى المجموعة الأخرى تطبيق موضعي من ميكرولتر واحد من الهكسان. وأظهرت الخلايا الغدية لمجموعة العمال الناشطين حديثًا التي لم تتلق أي علاج أن الخلايا الغدية لا تفرز بنشاط بعد. حدثت تغييرات في الخلايا الغدية وفقا لسن العامل ومنطقة الغدة. حدثت المرحلة الأكثر نشاطًا من الغدة من وقت ظهورها إلى اليوم الرابع عشر. في اليوم الخامس والعشرين ، فقدت الخلايا بالفعل خصائصها الإفرازية مع المنطقة البعيدة التي عانت من التدهور. أدى العلاج بهرمون الأحداث والهكسان إلى تغيير التسلسل الزمني للدورة الغدية ، مما يحيل الدورة الإفرازية وانحلال غدة السم. يحتوي سم نحل العسل على العديد من الإنزيمات والببتيدات والأمينات النشطة. وقد اعتبرت العوامل المميتة الرئيسية للثدييات هي فوسفوليباز أ 2 وميليتين وأبامين ، والتي توجد في السم بكميات تتراوح بين 15-20٪ و 40-60٪ و 2٪ على التوالي (Schmidt 1995). المكون الرئيسي في سم نحل العسل هو ميليتين الببتيد ، والذي عند الحقن يطلق الهيستامين من الخلايا البدينة ويمزق كريات الدم الحمراء ، مما يسبب الألم والتورم. يوجد نوعان من الببتيدات الأخرى: الآبامين والببتيد المتحلل من الخلايا البدينة الذي يطلق أيضًا الهيستامين من الخلايا البدينة ، مما يساهم في التورم. يوجد إنزيمان: فوسفوليباز A2 و هيالورونيداز. يتسبب الأول في تفكك خلايا الدم الحمراء ويعمل لاحقًا كعامل نشر (مورس وهوبر 1985). المراجع: References Bachmayer, H., G. Kreil and G. Suchanek 1972. Synthesis of promelittin and melittin in the venom gland of queen and worker bees: patterns observed during maturation. J. Insect Physiol. 18: 1515-1521. Bridges, A.R. and M.D. Owen 1984. The morphology of the honey bee (Apis mellifera L.) venom gland and reservoir. J. Morphol. 181: 69-86. Goodman, L. 2003. Form and Function in the Honey Bee. International Bee Research Association, Cardiff, UK, 220 pp. Habermann, E. 1972. Bee and wasp venom. Science 177: 314-322. Kato, M. 1994. Caste-specific and age-related toxic activities of honeybee venom on the same species of honeybees. Honeybee Sci. 15: 119-122. Kreil, G. and H. Bachmayer 1971. Biosynthesis of melittin, a toxic peptide from bee venom, detection of a possible precursor. Eur. J. Biochem. 20: 344-350. Martin, S.J., V. Dils and J. Billen 2005. Morphology of the Dufour gland within the honey bee sting gland complex. Apidologie 36: 543-546. Morse, R. and T. Hooper 1985. Venom, In The Illustrated Encyclopedia of Beekeeping, E.P. Dutton, Inc., New York, NY, pg. 398. Owen, M.D. and J.L. Braidwood 1974. A quantitative and temporal study of histamine and histidine in honey bee (Apis mellifera L.) venom. J. Canad. Zool. 52: 387-392. Owen, M.D. and A.R. Bridges 1976. Aging in the venom glands of queen and worker honey bees (Apis mellifera L.): some morphological and chemical observations. Toxicon 14: 1-5. Owen, M.D. and A.R. Bridges 1982. Catecholamines in honey bee (Apis mellifera L) and various vespid (Hymenoptera) venoms. Toxicon 20: 1075-1084. Owen, M.D. and L.A. Pfaff 1995. Melittin synthesis in the venom system of the honey bee (Apis mellifera L.). Toxicon 33: 1181-1188. Owen, M.D., J.L. Braidwood and A.R. Bridges 1977. Age-dependent changes in histamine content of venom of queen and worker honey bees. J. Insect Physiol. 23: 1031-1035. Owen, M.D., L.A. Pfaff, R.E. Reisman and J. Wypych 1990. Phospholipase A2 in venom extracts from honey bees (Apis mellifera L.) of different ages. Toxicon 28: 813-820. Peiren, N., D.C. de Graaf, F. Vanrobaeys, E.L. Danneels, B. Devreese, J. Van Beeumen and F.J. Jacobs 2008. Proteomic analysis of the honey bee worker venom gland focusing on the mechanisms of protection against tissue damage. Toxicon 52: 72-83. Roat, T.C., R.C.F. Nocelli and C. Cruz-Landim 2006a. Ultrastructural modifications in the venom glands of workers of Apis mellifera L. (Hymenoptera: Apidae) promoted by topical application of juvenile hormone. Neotrop. Entomol. 35: 469-476. Roat, T.C., R.C.F. Nocelli and C. Cruz-Landim 2006b. The venom gland of queens of Apis mellifera (Hmenoptera: Apidae): morphology and secretory cycle. Micron 37: 717-723. Schmidt, J.O. 1995. Toxinology of venoms from the honeybee genus Apis. Toxicon 33: 917-927. Seeley, T. 1985. Honeybee Ecology: A Study of Adaption of Social Life. Princeton University Press, Princeton, NJ. Snodgrass, R.E. 1956. Anatomy Of The Honey Bee, Comstock Publ. Assoc., Ithaca, NY, 2nd ed. Stell, I. 2012. Understanding Bee Anatomy: a full colour guide. The Catford Press, London, 203 pp. Winston, M.L. 1987. The Biology Of The Honey Bee. Harvard University Press, Cambridge, MA, 281 pp. Clarence Collison is an Emeritus Professor of Entomology and Department Head Emeritus of Entomology and Plant Pathology at Mississippi State University, Mississippi State, MS. المرجع https://www.beeculture.com/a-closer-look-venomvenom-glands/
تاريخ النشر بالموقع 1 - 8 - 2020
مسموح النقل من الموقع شريطة ذكر الموقع والمؤلف * www.na7la.com * منذ عام 2007
|